¿Qué hace que los metales sean tan versátiles e indispensables en ingeniería? Este artículo explora los fundamentos esenciales de la cristalización, la estructura y las transformaciones de los metales. Descubra cómo los metales pasan del estado líquido al sólido, la importancia de los defectos cristalinos y el fascinante fenómeno del superenfriamiento. La comprensión de estos principios le permitirá comprender mejor las propiedades de los metales y sus aplicaciones en diversos sectores industriales.
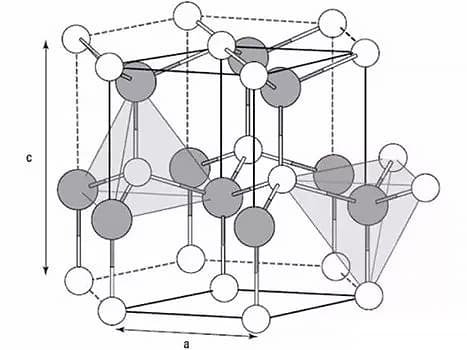
Los metales son cristales en estado sólido.
La estructura cristalina está relacionada con las propiedades, la deformación plástica y las transformaciones de fase por tratamiento térmico de los metales.
Las tres redes más comunes en los metales son la red cúbica centrada en el cuerpo, la red cúbica centrada en la cara y la red hexagonal compacta.
Los defectos de los cristales pueden clasificarse en tres categorías en función de su forma geométrica: defectos puntuales, defectos lineales y defectos planos.
El proceso por el que un metal pasa del estado líquido al sólido (cristalino) se conoce como cristalización de metales.
(1) Curva de enfriamiento y el fenómeno del superenfriamiento
La curva de enfriamiento es un gráfico que muestra la relación entre la temperatura y el tiempo durante el proceso de enfriamiento de un material. La curva de enfriamiento de un cristal metálico puede determinarse utilizando métodos de análisis térmico. El proceso consiste en fundir el metal para alcanzar una temperatura lo más uniforme posible, enfriarlo a una velocidad establecida, registrar los cambios de temperatura a lo largo del tiempo y trazar los datos en un gráfico temperatura-tiempo para obtener la curva de enfriamiento, como se muestra en la Figura 1.
El calor latente de cristalización que se libera durante la cristalización contrarresta la pérdida de calor del metal hacia el exterior, haciendo que aparezca una línea horizontal en la curva de enfriamiento. La temperatura correspondiente a esta línea es la temperatura real de cristalización del metal.
Los experimentos demuestran que la temperatura de cristalización real (T1) del metal es siempre inferior a la temperatura de cristalización teórica (T0). Este fenómeno se denomina superenfriamiento. El superenfriamiento es un requisito para que se produzca la cristalización. La diferencia entre T0 y T1, △T = T0 - T1, se conoce como grado de superenfriamiento.
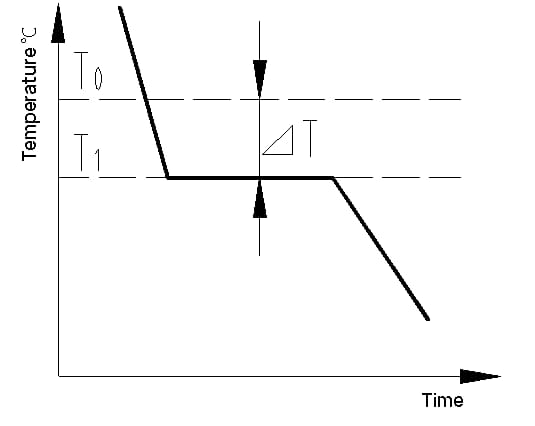
Fig. 1 Curva de enfriamiento del cristal de hierro puro
(2) Proceso de cristalización
El proceso de cristalización implica la creación y expansión de núcleos. Este proceso se conoce como nucleación y crecimiento.
El fenómeno por el que un metal pasa de una estructura reticular a otra al cambiar la temperatura en estado sólido se conoce como transformación isomórfica.
Algunos metales que presentan esta transformación son el hierro, el cobalto, titanioestaño y manganeso.
Los cristales del mismo elemento metálico que existen en diferentes formas de red se denominan cristales alotrópicos del metal.
Fase: Se refiere a los componentes uniformes dentro de una aleación (o metal puro) que poseen la misma composición, estructura y propiedades, y que están separados entre sí por una interfase.
La estructura de fases en las aleaciones puede dividirse en dos tipos en función de la interacción entre los elementos constitutivos: solución sólida y compuesto metálico.
(1) Solución sólida: Cuando la aleación líquida se solidifica, los elementos aún pueden disolverse entre sí para formar una fase en la que los átomos de un elemento se dispersan por la red de otro elemento. Esta fase se conoce como solución sólida.
(2) Compuesto metálico.
El diagrama de fases de aleación, también conocido como diagrama de equilibrio de aleación o diagrama de estado de aleación, es un diagrama que ilustra la relación entre la temperatura, la composición y el estado de una aleación en condiciones de equilibrio. Representa las leyes de cambio estructural de aleaciones con composiciones variables a medida que se enfrían o calientan lentamente hasta el infinito.
El diagrama de fases de aleación es una herramienta importante para seleccionar la composición de aleación adecuada, analizar la microestructura de la aleación, estudiar sus propiedades y determinar los procesos de fundición, forja y tratamiento térmico.
(1) Diagrama de fases homogéneo: Este tipo de diagrama representa un sistema de aleación en el que dos componentes pueden ser infinitamente miscibles tanto en estado líquido como sólido. Durante la solidificación, la aleación forma una solución sólida a partir de la fase líquida, un proceso conocido como transformación homogénea.
(2) Diagrama de fase eutéctica: En este diagrama, dos componentes son completamente miscibles en estado líquido y tienen una transformación eutéctica. La transformación eutéctica se refiere a la cristalización simultánea de dos fases sólidas con una composición específica a partir de una fase líquida uniforme con una composición específica a una temperatura determinada.
(3) Diagrama de fase peritéctico: En este diagrama, dos componentes son infinitamente miscibles en estado líquido y forman una solución sólida finita en estado sólido. También existe un estado de transformación peritéctica. La transformación peritéctica se refiere a la reacción entre la fase líquida de un determinado componente y la fase sólida de otro componente, que da lugar a la formación de una nueva fase sólida a temperatura constante.

El acero es una aleación de hierro y carbono con una composición específica.
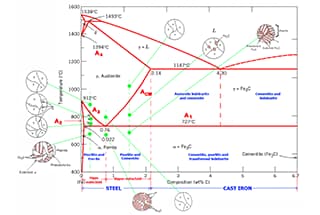
El diagrama de fases de las aleaciones de hierro-carbono ilustra las distintas estructuras de equilibrio de las aleaciones de hierro-carbono con distintas composiciones a diferentes temperaturas, como se representa en el diagrama de fases Fe-Fe3C.
A partir del diagrama de fases Fe-Fe3C, podemos determinar la temperatura a la que se produce la transformación de fase en una aleación de hierro-carbono de una determinada composición, también conocida como punto crítico.
Analizando el diagrama de fases Fe-Fe3C, es posible predecir el proceso de transformación de fases en diferentes regiones de temperatura y la posible estructura de equilibrio tras el enfriamiento a temperatura ambiente.
Consulte los puntos característicos del diagrama de fases Fe-Fe3C para obtener una descripción de cada punto del diagrama de fases de la aleación hierro-carbono y las líneas características para obtener una descripción de cada línea.
Según el diagrama de fases de la aleación hierro-carbono, el acero al carbono con contenido en carbono inferior a 2,11% y fundición con contenido en carbono superior a 2,11%.
En función de las características estructurales, la aleación hierro-carbono se divide en siete categorías según el contenido de carbono en el diagrama de fases de la aleación hierro-carbono:
(1) Hierro puro industrial, con contenido de carbono < 0,0218%;
(2) Acero eutectoide, con contenido de carbono 0,77%;
(3) Acero hipoeutectoide, con un contenido de carbono comprendido entre 0,0218% y 0,77%;
(4) Acero hipereutectoide, con un contenido de carbono comprendido entre 0,77% y 2,11%;
(5) Fundición blanca eutéctica, con contenido de carbono 4.30%;
(6) Fundición blanca subcristalina, con un contenido de carbono comprendido entre 2,11% y 4,30%;
(7) Fundición blanca supercristalina, con un contenido de carbono comprendido entre 4,30% y 6,69%.
Metal: Material con buena conductividad térmica y eléctrica, caracterizado por su aspecto opaco y brillo metálico. La conductividad de los metales disminuye al aumentar la temperatura, y son conocidos por su ductilidad y capacidad de expansión.
Un cristal metálico es un sólido en el que los átomos se disponen siguiendo un patrón regular.
Aleación: Sustancia con propiedades metálicas compuesta por dos o más elementos, incluidos metales y no metales.
Fortalecimiento de la solución sólida: Se produce cuando los átomos de soluto ocupan los espacios o intersticios de la red del disolvente, provocando la distorsión de la red y aumentando el dureza y resistencia de la solución sólida.
Compuesto: Una nueva estructura sólida cristalina con propiedades metálicas se forma por la combinación de componentes de aleación.
Mezcla mecánica: Composición de aleación formada por dos estructuras cristalinas distintas, aunque parezca una sola entidad con propiedades mecánicas independientes.
Ferrita: Solución sólida intersticial de carbono en alfa-Fe (hierro cúbico centrado en el cuerpo).
Austenita: Solución sólida intersticial de carbono en gamma-Fe (hierro cúbico centrado en la cara).
Cementita: Compuesto estable (Fe3C) formado por la combinación de carbono y hierro.
Perlita: Mezcla mecánica compuesta de ferrita y cementita (F + Fe3C, que contiene 0,8% de carbono).
Ledeburita: Mezcla mecánica compuesta de cementita y austenita (que contiene 4,3% de carbono).

El tratamiento térmico de los metales es un proceso crucial en la fabricación mecánica. A diferencia de otros métodos de procesamiento, el tratamiento térmico no altera la forma ni la composición química general de la pieza, sino que mejora su rendimiento modificando su microestructura o su composición química superficial.
La finalidad del tratamiento térmico es mejorar la calidad interna de la pieza, que a menudo no es visible a simple vista. Para conseguir las propiedades mecánicas, físicas y químicas deseadas de una pieza metálica, a menudo es necesario un tratamiento térmico, además de la selección adecuada de los materiales y los diversos... procesos de conformado.
El acero es el material más utilizado en la industria mecánica, y su microestructura puede controlarse mediante tratamiento térmico. En consecuencia, el tratamiento térmico del acero es un aspecto importante del tratamiento térmico de los metales.
Además del acero, el tratamiento térmico también puede utilizarse para modificar las propiedades mecánicas, físicas y químicas del aluminio, el cobre, el magnesio, el titanio y sus aleaciones, lo que permite obtener diversas propiedades de servicio.