Vous êtes-vous déjà interrogé sur la vaste gamme de métaux qui composent notre monde ? Dans ce fascinant article de blog, nous allons partir à la découverte des différents types de métaux, des plus communs aux plus rares. Notre ingénieur mécanicien expert vous guidera à travers les propriétés et les applications uniques de chaque métal, en vous fournissant des informations qui vous captiveront. Préparez-vous à découvrir un monde de merveilles métalliques !

La liste suivante des métaux est classée selon différentes approches. Comme indiqué précédemment, il existe plus de 90 types de métaux distincts sur notre planète.
Vous pouvez télécharger une version PDF de cette liste au bas du tableau.
| Catégorie | Métaux |
|---|---|
| Métaux ferreux | Fer, chrome, manganèse |
| Métaux non ferreux | Aluminium, magnésium, potassium, sodium, calcium, strontium, baryum, cuivre, plomb, zinc, étain, cobalt, nickel, antimoine, mercure, cadmium, bismuth, or, argent, platine, ruthénium, rhodium, palladium, osmium, iridium, béryllium, lithium, rubidium, césium, titane, zirconium, hafnium, vanadium, Niobium, Tantale, Tungstène, Molybdène, Gallium, Indium, Thallium, Germanium, Rhénium, Lanthane, Cérium, Praséodyme, Néodyme, Samarium, Europium, Gadolinium, Terbium, Dysprosium, Holmium, Erbium, Thulium, Ytterbium, Lutétium, Scandium, Silicium, Bore, Sélénium, Tellure, Arsenic, Thorium |
| Métaux courants | Fer, aluminium, cuivre, zinc |
| Métaux rares | Zirconium, Hafnium, Niobium, Tantale |
| Métaux légers | Titane, aluminium, magnésium, potassium, sodium, calcium, strontium, baryum (densité < 4500kg/m³) |
| Métaux lourds | Cuivre, nickel, cobalt, plomb, zinc, étain, antimoine, bismuth, cadmium, mercure (densité > 4500kg/m³) |
| Métaux précieux | Or, argent, métaux du groupe du platine |
| Éléments métalloïdes | Germanium, Antimoine, Polonium |
| Métaux rares | Métaux rares légers (lithium, rubidium, césium), métaux rares réfractaires (zirconium, molybdène, tungstène), métaux rares dispersés (gallium, indium, germanium, thallium), métaux de terres rares (scandium, yttrium, série des lanthanides), métaux radioactifs (radium, francium, polonium, uranium, thorium). |
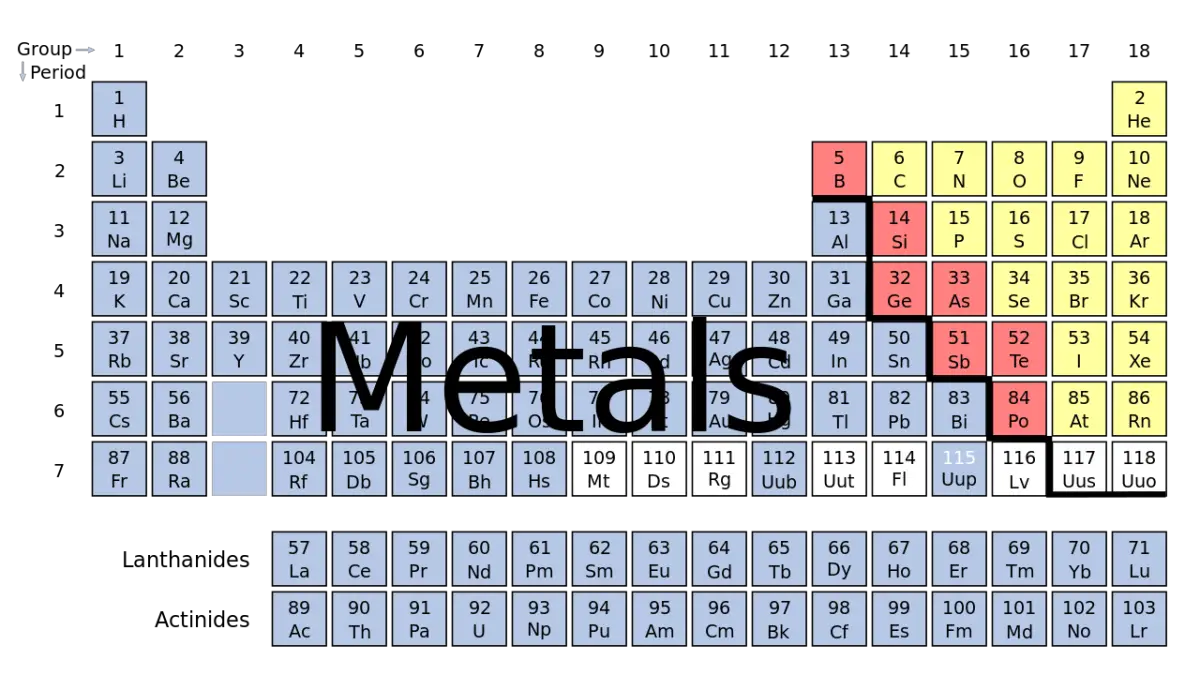
Comprendre le nombre total de métaux existants peut s'avérer assez complexe en raison de la vaste gamme d'éléments. À l'heure actuelle, le tableau périodique compte un total de 118 éléments connus, dont environ 90 sont classés comme métaux. Ce nombre inclut trois éléments souvent appelés métalloïdes ou semi-métaux : le bore, le silicium et l'arsenic.
Pour simplifier la compréhension, les métaux sont généralement divisés en deux catégories principales : les métaux ferreux et les métaux non ferreux. Ce système de classification est largement accepté aux États-Unis, en Grande-Bretagne et au Japon.
Métaux ferreux
Les métaux ferreux contiennent du fer et sont connus pour leur résistance et leur durabilité. Les exemples les plus courants sont les suivants :
Métaux non ferreux
Les métaux non ferreux ne contiennent pas de fer et sont généralement plus résistants à la rouille et à la corrosion. En voici quelques exemples :
Lecture connexe : Métaux ferreux et non ferreux
Dans le passé, l'ex-Union soviétique et certains pays d'Europe de l'Est classaient les métaux en deux groupes en fonction de leur couleur : les métaux noirs et les métaux colorés. De même, cette classification basée sur la couleur est encore utilisée en Chine. Toutefois, cette approche n'est pas scientifiquement valable.
En fonction de leurs propriétés et de leurs applications, les métaux sont aujourd'hui classés en quatre groupes distincts :
Métaux lourds:
Les métaux lourds sont définis comme des métaux dont la densité est supérieure à 4,5 g/cm³. En voici quelques exemples :
Métaux légers:
Les métaux légers ont une densité inférieure à 4,5 g/cm³. En voici quelques exemples :
Métaux précieux:
Les métaux précieux sont très appréciés en raison de leur faible taux d'impureté, de leurs processus de purification complexes et de leur grande valeur. Ces métaux sont considérés comme plus précieux que les métaux ordinaires. En voici quelques exemples :
Métaux rares:
Les métaux rares comprennent des éléments relativement peu courants, tels que les métaux légers rares, les métaux réfractaires, les métaux dispersés et les métaux de terre rare. En voici quelques exemples :
Métaux radioactifs:
Il est important de noter qu'il existe également une catégorie de métaux radioactifs qui peuvent être nocifs pour la santé humaine. Une exposition prolongée à ces métaux peut entraîner des maladies, voire la mort. En voici quelques exemples :
Conclusion
Cet article vise à fournir une liste complète des différents types de métaux, couvrant presque tous les éléments trouvés dans le tableau périodique des éléments chimiques. En outre, nous présenterons une vue d'ensemble des caractéristiques et des applications de ces métaux.
Commençons.

Le fer est un élément métallique dont le numéro atomique est 26 et qui est représenté par le symbole chimique Fe, dérivé de son nom latin "Ferrum". Sa masse atomique relative moyenne est de 55,845 unités de masse atomique (amu). Le fer est l'un des éléments les plus abondants sur Terre et joue un rôle crucial dans diverses applications industrielles, notamment dans la production d'acier.
Le fer est essentiel dans de nombreux domaines en raison de sa polyvalence et de son abondance. Il est un composant essentiel dans la fabrication de l'acier, qui est un alliage de fer et de carbone. L'acier est essentiel à la construction, à l'automobile et à diverses autres industries en raison de sa résistance et de sa durabilité.

Le chrome est un élément métallique appartenant au groupe 6B du tableau périodique des éléments, dont le symbole chimique est Cr et le numéro atomique 24. Son nom est dérivé du mot grec signifiant "couleur", ce qui s'explique par la nature colorée des composés du chrome.
Ce métal gris acier est le plus dur qui existe dans la nature. Le chrome n'est présent qu'en petites quantités dans la croûte terrestre, se classant au 17e rang en termes d'abondance avec seulement 0,01%. Le chrome naturel libre est extrêmement rare et se trouve principalement dans la chromite.

Le manganèse est un métal de transition dont le symbole chimique est Mn et le numéro atomique 25. Il se présente sous la forme d'un élément blanc grisâtre, dur, cassant et brillant.
Si le manganèse pur est légèrement plus tendre que le fer, il devient ferme et cassant lorsqu'il contient de petites quantités d'impuretés et peut facilement s'oxyder dans les environnements humides.
Le manganèse est largement répandu dans la nature, le sol contenant généralement environ 0,25% de cet élément. Certains aliments, comme le thé, le blé et les fruits à coque dure, contiennent des quantités plus élevées de manganèse.

L'aluminium, symbolisé par Al, est un métal léger ductile, blanc argenté, couramment utilisé pour créer divers produits tels que des barres, des tôles, des feuilles, des poudres, des bandes et des filaments.
Dans l'air humide, l'aluminium peut former un film d'oxyde qui le protège contre la corrosion. Lorsqu'elle est chauffée à l'air, la poudre d'aluminium peut s'enflammer et produire une flamme blanche et brillante. Il est soluble dans les solutions diluées d'acide sulfurique, d'acide nitrique, d'acide chlorhydrique, d'hydroxyde de sodium et d'hydroxyde de potassium, mais insoluble dans l'eau.
L'aluminium a une densité relative de 2,70 et ses points de fusion et d'ébullition sont respectivement de 660°C et 2327°C.
L'aluminium est notamment l'élément métallique le plus abondant dans la croûte terrestre, en troisième position après l'oxygène et le silicium.

Le magnésium est un élément métallique représenté par le symbole chimique Mg. Il a été produit pour la première fois par le chimiste britannique Sir Humphry Davy en 1808 en réduisant l'oxyde de magnésium avec du potassium.
En tant que métal alcalino-terreux, le magnésium est un métal léger, blanc argenté, qui présente des propriétés chimiques réactives. Il réagit avec les acides pour produire de l'hydrogène et présente une certaine ductilité et des capacités de dissipation de la chaleur.
Le magnésium est naturellement abondant et constitue un élément essentiel pour le corps humain.

Le potassium est un métal alcalin dont le symbole est K et le numéro atomique 19. Il appartient au groupe 1A de la quatrième période du tableau périodique des éléments.
Ce métal mou et cireux a un aspect blanc argenté et peut être facilement coupé avec un couteau. Son point de fusion et d'ébullition est bas et sa densité est inférieure à celle de l'eau. Le potassium présente des propriétés chimiques très réactives, plus encore que le sodium.
Le sodium, également connu sous le symbole Na et le nom commun Sodium, est un élément métallique situé dans le groupe 1A de la troisième période du tableau périodique. Il est un représentant des éléments métalliques alcalins.
Le sodium a une texture douce et présente des propriétés chimiques très réactives. Lorsqu'il entre en contact avec de l'eau, il réagit vigoureusement en produisant de l'hydroxyde de sodium et en libérant de l'hydrogène.

Le calcium est un élément métallique dont le numéro atomique est 20 et qui porte le symbole Ca. Il fait partie du groupe 2A et de la quatrième période du tableau périodique des éléments.
À température ambiante, le calcium est un solide blanc argenté aux propriétés chimiques très réactives. En raison de sa réactivité, on le trouve principalement dans la nature sous forme d'ions ou de composés.

Le strontium est un élément chimique de symbole Sr, découvert en 1791-1792 par le chimiste et médecin britannique Sir Henry Hope lors de l'étude d'un minerai. Il l'a nommé strontia (terre de strontium) d'après son lieu d'origine, Strontian.
Le strontium est un métal alcalino-terreux blanc argenté à l'éclat jaune. Il est utilisé dans la production d'alliages, de cellules photoélectriques, de réactifs chimiques analytiques, de feux d'artifice et d'autres applications.
L'un de ses isotopes, le strontium 90, est radioactif et a une demi-vie de 28,1 ans, ce qui le rend utile comme source de rayonnement.

Le baryum est un métal alcalino-terreux de symbole chimique Ba, situé dans le groupe 2A de la sixième période du tableau périodique. Il s'agit d'un métal doux, blanc argenté, à l'aspect brillant, qui est l'élément le plus réactif parmi les métaux alcalino-terreux.
En raison de sa nature hautement réactive, le baryum ne se trouve pas à l'état pur dans la nature. Les minéraux de baryum les plus courants dans la nature sont la barytine (sulfate de baryum) et la withérite (carbonate de baryum), qui sont toutes deux insolubles dans l'eau.
Bien que le baryum ait été reconnu comme un nouvel élément en 1774, il n'a été classé comme élément métallique qu'après l'invention de l'électrolyse en 1808.
Les composés de baryum sont utilisés dans les feux d'artifice pour produire une coloration verte selon le principe de la réaction de la flamme.

Le cuivre est un élément de transition et un métal dont le symbole chimique est Cu et le numéro atomique 29.
À l'état pur, le cuivre est un métal mou de couleur rouge-orange qui présente un éclat métallique lorsqu'il est fraîchement coupé. Sa forme élémentaire est rouge-violacé.
Le cuivre est très ductile et possède une excellente conductivité thermique et électrique. Grâce à ces propriétés, il est largement utilisé dans les composants électriques et électroniques, ainsi que dans les câbles. Il peut également être utilisé dans les matériaux de construction et peut former de nombreux alliages, notamment le bronze et le laiton, qui présentent une faible résistivité et d'excellentes propriétés mécaniques.
Le cuivre est un métal durable qui peut être recyclé plusieurs fois sans perdre ses propriétés mécaniques.
Lecture connexe : Types de laiton

Le plomb est un élément chimique métallique de symbole Pb, de numéro atomique 82 et de poids atomique 207,2. Il s'agit de l'élément non radioactif le plus lourd, avec une structure cristalline cubique à faces centrées. Le plomb est un métal lourd, non ferreux et résistant à la corrosion.
Le plomb présente plusieurs avantages, notamment un point de fusion bas, une résistance élevée à la corrosion, une impénétrabilité aux rayons X et gamma et une bonne plasticité. En raison de ces propriétés, il est couramment transformé en feuilles et en tuyaux et utilisé dans diverses industries, telles que la fabrication de produits chimiques, la production de câbles, la fabrication de batteries et la radioprotection.

Le zinc est un élément chimique de symbole Zn et de numéro atomique 30. Il appartient au groupe 12 de la quatrième période du tableau périodique des éléments. Le zinc est un métal de transition gris clair et le quatrième métal le plus utilisé dans l'industrie moderne. C'est un métal essentiel dans la production de batteries.

L'élément métallique connu sous le nom de stannum est communément appelé étain en anglais, et son symbole élémentaire est Sn.
L'étain est une substance inorganique qui se présente généralement sous la forme d'un métal à bas point de fusion et à l'éclat blanc argenté, sous sa forme la plus courante, l'étain blanc.
Dans les composés, l'étain peut présenter une valence de deux ou quatre, et il n'est pas facilement oxydé dans l'air à température ambiante.
L'étain se trouve à l'état naturel principalement sous forme de dioxyde (cassitérite) et de divers sulfures, tels que le sulfure stannique.
Lecture connexe : Types d'étain

Le cobalt, symbolisé par Co, est un métal ferromagnétique dont la surface est blanc argenté et la teinte légèrement rosée. Il appartient au huitième groupe et à la quatrième période du tableau périodique, avec un numéro atomique de 27 et un poids atomique de 58,9332.
Le cobalt a une structure cristalline hexagonale très serrée et peut généralement avoir une valence de +2 et +3. C'est un métal brillant, gris acier, relativement dur et cassant, ferromagnétique, qui perd son magnétisme lorsqu'il est chauffé à 1150 ℃. À température ambiante, il est inerte à l'eau et stable dans l'air humide.
Lorsqu'il est chauffé à des températures supérieures à 300 ℃ dans l'air, l'oxyde de cobalt (CoO) subit une oxydation et se transforme en oxyde de cobalt (Co3O4) avec une chaleur blanche et brillante. Une fine poudre de cobalt métallique, produite par réduction de l'hydrogène, peut se transformer spontanément en oxyde de cobalt dans l'air.
Le cobalt est une matière première essentielle utilisée dans la fabrication d'alliages résistants à la chaleur, d'alliages durs, d'alliages anticorrosion, d'alliages magnétiques et de divers sels de cobalt.

Le nickel est un métal dur, ductile et ferromagnétique qui possède une grande brillance et une excellente résistance à la corrosion. Il s'agit d'un élément ferrophile et il est abondant dans le noyau de la Terre, qui se compose principalement de fer et de nickel. La teneur en nickel des roches ferro-magnésiennes de la croûte terrestre est plus élevée que celle des roches aluminosilicatées. Par exemple, la péridotite a une teneur en nickel 1000 fois supérieure à celle du granite, tandis que le gabbro a une teneur en nickel 80 fois supérieure à celle du granite.

L'antimoine est un élément métallique dont le symbole chimique est Sb et le numéro atomique 51. Il s'agit d'un métal blanc argenté, brillant, dur et cassant, qui peut être transformé en barres, en blocs, en poudre et en d'autres formes. L'antimoine a une structure cristalline écailleuse et perd son éclat au fil du temps lorsqu'il est exposé à l'air humide. Lorsqu'il est exposé à des températures élevées, il brûle et se transforme en oxyde d'antimoine blanc. L'antimoine est soluble dans l'eau régale et l'acide sulfurique concentré. Sa densité relative est de 6,68, son point de fusion de 630°C et son point d'ébullition de 1635°C. Son rayon atomique est de 1,28 angström et son électronégativité est de 2,2.

Le mercure, désigné par le symbole chimique Hg, est le 80e élément du tableau périodique et appartient au groupe 12 et à la 6e période.
Ce qui rend le mercure unique, c'est qu'il est le seul métal qui existe sous forme liquide à une température et une pression normales. Cependant, le gallium (symbole Ga, élément 31) et le césium (symbole Cs, élément 55) existent également à l'état liquide à température ambiante (29,76°C et 28,44°C, respectivement).
Le mercure a un aspect brillant, blanc argenté, et est un liquide dense aux propriétés chimiques stables. Il est insoluble dans les acides et les bases.
À température ambiante, le mercure peut s'évaporer. Les vapeurs de mercure et leurs composés sont hautement toxiques et peuvent avoir des effets chroniques sur la santé.
Le mercure est utilisé depuis longtemps et l'est encore largement aujourd'hui.

Le cadmium est un élément métallique lourd et non ferreux dont le symbole chimique est Cd et le numéro atomique 48. C'est un métal blanc argenté qui possède d'excellentes propriétés d'absorption des neutrons. Les barres de cadmium sont utiles pour ralentir la réaction de fission en chaîne dans les réacteurs nucléaires. Il est également utilisé dans les piles zinc-cadmium.
La forme sulfurée du cadmium a une couleur vive et est utilisée pour produire le pigment jaune connu sous le nom de jaune de cadmium.

Le bismuth est un élément métallique représenté par le symbole chimique Bi et le numéro atomique 83. Il appartient au groupe VA de la 6e période du tableau périodique.
Le bismuth a un aspect unique avec sa couleur blanc argenté à rose, et c'est un métal fragile qui peut être facilement écrasé. Il présente des propriétés chimiques relativement stables.
Le bismuth peut être trouvé sous sa forme métallique libre ainsi que dans divers minéraux dans la nature.

L'or (symbole : Au, numéro atomique : 79) est un élément métallique souvent appelé métal précieux en raison de son utilisation historique comme monnaie d'échange, comme moyen de conservation de la valeur et comme bijou.
L'or naturel se trouve sous forme de pépites ou de grains dans les roches, les veines souterraines et les alluvions.
L'or, qui fait partie des métaux monétaires, est solide à température ambiante et est connu pour sa densité élevée, sa douceur, sa brillance et sa résistance à la corrosion. C'est le deuxième métal le plus ductile, après le platine.

L'argent, désigné par son symbole chimique Ag, est un métal de transition utilisé depuis l'Antiquité et reconnu comme un métal précieux important.
Bien que l'on puisse trouver de l'argent à l'état naturel, il est principalement disponible sous forme chimique dans le minerai d'argent. Il possède des caractéristiques physiques et chimiques relativement stables, notamment une excellente conductivité thermique et électrique. Ce métal doux et malléable réfléchit plus de 99% de la lumière, ce qui le rend très réfléchissant. En raison de ses nombreuses applications cruciales, l'argent conserve sa valeur en tant que métal précieux.

Le platine est un élément chimique représenté par le symbole Pt et est considéré comme l'un des métaux précieux. Appartenant à la série des éléments du platine, il est communément appelé simplement "platine". Avec un poids atomique de 195,078 et un numéro atomique de 78, il s'agit d'un métal de transition.
Le platine a un point de fusion de 1772°C, un point d'ébullition de 3827°C et une densité de 21,45 g/cm³ à 20°C. Il est relativement mou et possède une bonne ductilité, une bonne conductivité thermique et une bonne conductivité électrique. Il est relativement mou et possède une bonne ductilité, une bonne conductivité thermique et une bonne conductivité électrique.
Le platine éponge est un matériau gris, semblable à une éponge, qui présente une grande surface spécifique et une forte capacité d'absorption des gaz, en particulier de l'hydrogène, de l'oxygène et du monoxyde de carbone. Le noir de platine en poudre peut absorber une quantité importante d'hydrogène.
Le ruthénium est un élément métallique rare et multivalent qui se caractérise par sa dureté, sa fragilité et son aspect gris clair. Il a pour symbole chimique Ru et appartient aux métaux du groupe du platine.
Bien que présent dans la croûte terrestre, le ruthénium est l'un des métaux les plus rares, avec une concentration de seulement un milliardième. Il est réputé pour ses propriétés stables et sa grande résistance à la corrosion.
Le ruthénium résiste à la corrosion par l'acide chlorhydrique, l'acide sulfurique, l'acide nitrique et l'eau régale à température ambiante.
Bien que le ruthénium soit le moins cher des métaux du groupe du platine, il reste moins abondant que d'autres métaux comme le platine et le palladium.

Le rhodium est un métal dur, blanc argenté, représenté par le symbole chimique Rh. Il appartient aux éléments du groupe du platine et est connu pour sa grande réflectivité.
Normalement, le rhodium métal ne forme pas d'oxydes, mais lorsqu'il est à l'état fondu, il peut absorber de l'oxygène et le libérer lors de la solidification.
Par rapport au platine, le rhodium a un point de fusion plus élevé et une densité plus faible. En outre, il est insoluble dans la plupart des acides et complètement insoluble dans l'acide nitrique. Il n'est que légèrement soluble dans l'eau régale.
Le palladium est un métal de transition appartenant au groupe du platine, dont le symbole chimique est Pd. Il est situé dans le groupe VIII de la cinquième période du tableau périodique.
Dans sa forme pure, le palladium est un métal blanc argenté qui a une texture douce et une bonne ductilité et plasticité. Il est donc facile de le forger, de le rouler et de l'étirer pour lui donner différentes formes.
Le palladium a la particularité de pouvoir absorber l'hydrogène gazeux, ce qui se traduit par une augmentation significative du volume. Toutefois, cette propriété peut également rendre le métal cassant et même le faire éclater en fragments.

L'osmium est un élément chimique de symbole Os et de numéro atomique 76. Il appartient au groupe VIII de la 6e période du tableau périodique et a une masse atomique relative de 190,23.
Membre du groupe du platine, l'osmium est un métal lourd dont la densité est la plus élevée de tous les éléments.

L'iridium est un élément métallique dont le symbole chimique est Ir et le numéro atomique 77. Son poids atomique est de 192,22 et son nom est dérivé du mot latin signifiant "arc-en-ciel".
L'iridium est rare dans la croûte terrestre, sa concentration n'étant que de 1/10 million. Il est généralement dispersé dans divers minerais et peut être trouvé dans des dépôts alluviaux et sablonneux, avec d'autres éléments de la série du platine.
Le béryllium est un élément chimique représenté par le symbole Be et ayant un numéro atomique de 4. Il est classé dans le deuxième groupe principal et la deuxième période du tableau périodique.
Ce métal alcalino-terreux gris-blanc appartient au système hexagonal et est connu pour sa dureté et son faible coefficient de dilatation thermique. Il doit cependant être manipulé avec précaution, car le béryllium et ses composés sont hautement toxiques.
Le béryllium est un métal amphotère qui peut se dissoudre dans les acides comme dans les bases. Ses applications sont diverses, allant de son utilisation comme matériau dans les réacteurs d'énergie atomique et l'ingénierie aérospatiale à son incorporation dans divers alliages et comme composant dans les fenêtres de transmission de rayons X.

Le lithium est un élément métallique dont le symbole chimique est Li et dont l'aspect est doux et blanc argenté. Il a la densité la plus faible de tous les métaux.
Le lithium est utilisé dans diverses applications, notamment dans les réacteurs atomiques, les alliages légers et les batteries. Contrairement aux autres métaux alcalins, le lithium et ses composés ont des propriétés atypiques en raison de leur densité de charge élevée et de la stabilité de leur double couche d'électrons de type hélium. Par conséquent, ils sont facilement polarisés par d'autres molécules ou ions, mais difficiles à polariser eux-mêmes.
Cette caractéristique unique influe sur la stabilité du lithium et de ses composés. Le lithium possède le potentiel d'électrode le plus négatif de tous les éléments connus, y compris les éléments radioactifs, ce qui en fait le métal le plus réactif.

Le rubidium est un métal léger, blanc argenté, désigné par le symbole chimique Rb. Il a une texture douce et cireuse et présente des propriétés chimiques plus actives que le potassium.
Lorsqu'il est exposé à la lumière, le rubidium émet des électrons. Il réagit vigoureusement avec l'eau, produisant de l'hydroxyde de rubidium et de l'hydrogène. En outre, il réagit facilement avec l'oxygène pour former des oxydes complexes.
En raison de la chaleur importante générée lors de la réaction avec l'eau, il existe un risque d'inflammation immédiate de l'hydrogène. Par précaution, le rubidium métal pur est généralement stocké dans des récipients en verre scellés pour éviter tout contact avec l'air ou l'humidité.

Le césium est un élément du tableau périodique dont le symbole est Cs et le numéro atomique 55. Il est classé dans le groupe IA de la 6e période.
Sous sa forme élémentaire, le césium est un métal réactif de couleur jaune doré clair, dont le point de fusion est bas. Il est très sensible à l'air et sujet à l'oxydation.
Lorsque le césium entre en contact avec l'eau, il réagit violemment et peut exploser en produisant de l'hydrogène. Dans la nature, le césium n'existe que sous forme de sel et on le trouve rarement sur terre et en mer.
Le césium est un matériau important dans la production d'appareils à vide et de cellules photoélectriques. L'isotope radioactif Cs-137 fait partie des polluants qui se sont échappés de la centrale nucléaire de Fukushima Daiichi au Japon.
Le césium est le plus métallique de tous les éléments connus, y compris les éléments radioactifs. Il convient de noter que le lithium est l'élément le plus réactif.

Titane est un élément chimique de symbole Ti et de numéro atomique 22. Il appartient au groupe IVB de la quatrième période du tableau périodique et est un métal de transition blanc argenté connu pour sa légèreté, sa grande solidité, son éclat métallique et sa résistance à la corrosion par le chlore humide.
Cependant, l'exposition au chlore sec peut provoquer une réaction chimique violente dans le titane, même à des températures inférieures à 0°C. Cette réaction produit du tétrachlorure de titane. Cette réaction produit du tétrachlorure de titane et se décompose pour produire du dichlorure de titane, qui peut s'enflammer dans des cas extrêmes. Par conséquent, le titane ne peut rester stable que lorsque la teneur en eau du chlore est supérieure à 0,5%.
Le titane est considéré comme un métal rare en raison de sa dispersion dans la nature et de la difficulté de son extraction. Malgré cela, il est relativement abondant et occupe la dixième place parmi tous les éléments. Les principaux minerais de titane, l'ilménite et le rutile, sont largement répandus dans la croûte terrestre et la lithosphère. En outre, le titane est présent dans presque tous les organismes vivants, les roches, l'eau et le sol.

Le zirconium est un élément chimique de symbole Zr et de numéro atomique 40. C'est un métal gris clair avec un point de fusion élevé.
Lorsqu'elle est exposée à l'air, la surface du zirconium développe rapidement un film d'oxyde qui lui donne un aspect lustré, semblable à celui de l'acier. Il présente également une résistance exceptionnelle à la corrosion et est soluble dans l'acide fluorhydrique et l'eau régale.
Le zirconium peut réagir à la fois avec non métallique et des éléments métalliques à des températures élevées, formant des solutions solides.

Le vanadium est un élément métallique de symbole V. C'est un métal gris argenté qui appartient au groupe 5 du tableau périodique des éléments. Le vanadium a un numéro atomique de 23 et un poids atomique de 50,9414. Il a une structure cristalline cubique centrée et présente des valences communes de +5, +4, +3 et +2.
Le vanadium est classé parmi les métaux réfractaires en raison de son point de fusion élevé. En outre, il est ductile, dur et non magnétique. Le vanadium est également très résistant à l'acide chlorhydrique et à l'acide sulfurique, et il présente une meilleure résistance à la corrosion due aux gaz, aux sels et à l'eau que la plupart des types d'acier inoxydable.

Le niobium est un métal de transition dont le symbole chimique est Nb et le numéro atomique 41. C'est un métal gris et brillant.
Dans sa forme pure, le niobium est très ductile. Toutefois, sa dureté augmente avec la teneur en impuretés. En outre, le niobium a une section transversale très faible pour capturer les neutrons thermiques, ce qui le rend très précieux dans l'industrie nucléaire.

Le tantale est un élément métallique dont le numéro atomique est 73 et le symbole chimique Ta. Sa forme élémentaire est un métal gris acier qui présente une grande résistance à la corrosion.
Le tantale ne présente aucune réactivité vis-à-vis de l'acide chlorhydrique, de l'acide nitrique concentré ou de l'eau régale, que ce soit à froid ou à chaud. On le trouve principalement dans la tantalite, qui coexiste souvent avec le niobium.
Le tantale présente une dureté et une ductilité modérées et peut être étiré en fils minces ou en feuilles. Il possède un faible coefficient de dilatation thermique, d'excellentes propriétés chimiques et une grande résistance à la corrosion.
Le tantale est utilisé dans la production de cuves d'évaporation et comme électrode, redresseur et condensateur électrolytique dans les tubes électroniques. En médecine, il est utilisé pour créer des feuilles ou des fils minces destinés à réparer les tissus endommagés.
La forte résistance à la corrosion du tantale est due à la formation d'un film protecteur stable de pentoxyde de tantale (Ta2O5) à sa surface.

Le tungstène est un élément métallique dont le symbole chimique est W et le numéro atomique 74. Il appartient au groupe VIB de la sixième période du tableau périodique des éléments.
Dans la nature, le tungstène existe principalement sous la forme de cations hexavalents, dont le rayon ionique est de 0,68 x 10^-10 mètres. En raison de son faible rayon ionique, de son électronégativité élevée et de sa forte capacité de polarisation, il forme facilement des anions complexes. Ainsi, le tungstène se présente souvent sous la forme d'anions complexes, tels que [WO4]^2-, dans les précipités de wolframite ou de scheelite.
Sous sa forme élémentaire, le tungstène se présente comme un métal blanc argenté brillant, d'une grande dureté et d'un point de fusion élevé. Il est résistant à la corrosion par l'air à température ambiante et possède des propriétés chimiques relativement stables. Le tungstène a de nombreuses applications, notamment la fabrication de filaments, d'alliages de coupe à haute vitesse, de moules super-durs et d'instruments optiques et chimiques. La Chine détient les plus grandes réserves de tungstène au monde.

Le molybdène est un élément chimique de symbole Mo et de numéro atomique 42. Il appartient au groupe des métaux de transition et constitue un oligo-élément crucial pour la santé humaine, présent dans divers tissus de l'organisme tels que le foie et les reins.
Le corps humain contient environ 9 mg de molybdène au total. Ce métal blanc argenté est connu pour sa résistance et sa dureté, et il est important pour la croissance et le bien-être des plantes et des animaux.

Le gallium est un élément métallique de couleur bleu grisâtre ou blanc argenté, représenté par le symbole chimique Ga et un poids atomique de 69,723.
Bien que son point de fusion soit bas, le gallium a un point d'ébullition élevé. Lorsque le gallium est sous sa forme liquide pure, il a tendance à se refroidir excessivement et s'oxyde facilement dans l'air, ce qui entraîne l'apparition d'un film d'oxyde.

L'indium est un élément métallique de symbole "In" et de numéro atomique 49, appartenant au groupe IIIA de la cinquième période du tableau périodique.
À l'état pur, l'indium se présente comme un métal blanc argenté avec une légère teinte bleue. Il est extrêmement doux et peut être facilement rayé avec l'ongle. En outre, l'indium présente une malléabilité et une ductilité remarquables, ce qui lui permet d'être moulé sous différentes formes.
L'indium est principalement utilisé comme matériau de base dans la fabrication d'alliages à bas point de fusion, d'alliages pour roulements, de semi-conducteurs et de sources de lumière électrique.

Le thallium, symbolisé par Tl et de numéro atomique 81, est un élément du groupe IIIA qui appartient à la sixième période du tableau périodique.
Étant un élément rare, on le trouve en petites quantités dans l'environnement naturel. Le thallium se dissout lentement dans l'acide chlorhydrique et l'acide sulfurique dilué, mais il se dissout rapidement dans l'acide nitrique.
Les principaux composés du thallium sont les oxydes, les sulfures, les halogénures et les sulfates. Les sels de thallium sont des cristaux incolores et insipides qui se dissolvent dans l'eau pour former des composés de thallium.
Le thallium est relativement plus stable dans l'eau ou la paraffine que dans l'air.

Le germanium est un élément chimique de symbole Ge, de numéro atomique 32 et de poids atomique 72,64. Il fait partie de la 4e période et du groupe IVA du tableau périodique des éléments.
Le germanium est un métalloïde brillant, dur et blanc grisâtre. Il appartient au groupe du carbone et ses propriétés chimiques sont similaires à celles de l'étain et du silicium, qui appartiennent également au même groupe.
Le germanium est insoluble dans l'eau, l'acide chlorhydrique et les solutions caustiques diluées, mais il est soluble dans l'eau régale, l'acide nitrique concentré ou l'acide sulfurique. Il possède des propriétés amphotères et est soluble dans l'alcali fondu, l'alcali peroxyde, le nitrate de métal alcalin ou le carbonate. Il est relativement stable dans l'air.
Il existe cinq isotopes stables du germanium dans la nature : 70Ge, 72Ge, 73Ge, 74Ge et 76Ge. Lorsque le germanium réagit avec l'oxygène à une température supérieure à 700°C, il forme du GeO2. Lorsqu'il réagit avec l'hydrogène à plus de 1000°C, il peut s'enflammer dans le chlore ou le brome.
Le germanium est un excellent semi-conducteur et peut être utilisé pour détecter les courants à haute fréquence et redresser l'électricité en courant alternatif. Il peut également être utilisé comme matériau optique infrarouge, dans des instruments de précision et comme catalyseur. Les composés de germanium peuvent être utilisés pour fabriquer des plaques fluorescentes et divers verres à indice de réfraction élevé.

Le rhénium est un élément chimique désigné par le symbole Re et dont le numéro atomique est 75. Il s'agit d'un métal dense, blanc argenté, appartenant à la sixième période des métaux de transition dans le tableau périodique des éléments.
Le rhénium est un élément incroyablement rare que l'on trouve dans la croûte terrestre avec une concentration moyenne estimée à seulement un milliardième. Il est également connu pour avoir l'un des points de fusion et d'ébullition les plus élevés de tous les éléments.
Le processus de raffinage du molybdène et du cuivre produit du rhénium comme sous-produit. Le rhénium possède des propriétés chimiques comparables à celles du manganèse et du technétium.
Les composés du rhénium ont des états d'oxydation allant de -3 à +7, -3 étant l'état le plus bas et +7 le plus élevé.

Le lanthane est un élément métallique de terre rare dont le symbole chimique est La, le numéro atomique 57 et le poids atomique 138,90547. Le nom de l'élément vient de la langue grecque et signifie à l'origine "être caché".
Le lanthane a un éclat gris argenté et une texture douce, avec une densité de 6,162 g/cm3. Son point de fusion est de 920°C et son point d'ébullition de 3464°C à la pression atmosphérique. Il présente des propriétés chimiques actives et perd rapidement son éclat métallique lorsqu'il est exposé à l'air, formant une couche d'oxyde bleu. Toutefois, ce film n'est pas en mesure de protéger le métal, ce qui entraîne une oxydation continue et la formation d'une poudre d'oxyde blanche.
Le lanthane réagit lentement à l'eau froide, est soluble dans l'acide et peut réagir avec divers non-métaux. Le métal est généralement stocké dans de l'huile minérale ou un gaz rare.
La croûte terrestre contient 0,00183% de lanthane, ce qui en fait l'élément de terre rare le plus abondant après le cérium. Il existe deux isotopes naturels du lanthane : le lanthane-139 et le lanthane-138 radioactif.

Le cérium est un élément de terre rare dont le numéro atomique est 58. Il appartient au groupe des lanthanides IIIB de la sixième période du tableau périodique et est représenté par le symbole chimique Ce. Sous sa forme élémentaire, il se présente comme un métal réactif de couleur gris argenté.
Il convient de noter que le cérium est sujet à une combustion spontanée lorsqu'il est sous forme de poudre et qu'il peut se dissoudre dans les acides et les agents réducteurs.

Le praséodyme est un métal de terre rare dont le numéro atomique est 59. Son nom provient de la langue grecque et signifie "vert". Le praséodyme a une structure cristalline hexagonale.
Comparé au lanthane, au cérium, au néodyme et à l'europium, le praséodyme présente une plus grande résistance à la corrosion dans l'air. Cependant, lorsqu'il est exposé à l'air, il forme toujours une couche d'oxyde vert fragile. Le praséodyme pur doit être conservé dans de l'huile minérale ou dans un récipient en plastique scellé.
Le praséodyme est utilisé dans le craquage catalytique du pétrole. L'ajout de praséodyme et l'enrichissement en néodyme à un tamis moléculaire en Y-zéolite peuvent améliorer l'activité, la sélectivité et la stabilité d'un catalyseur de craquage pétrolier.
Comme les autres éléments de terres rares, le praséodyme est peu toxique et n'est pas essentiel pour les processus biologiques.

Le néodyme, symbolisé par Nd et dont le numéro atomique est 60, appartient à la série des lanthanides. C'est un métal blanc argenté et l'un des métaux de terre rare les plus réactifs.
Le néodyme a une densité de 7,004 g/cm³ et un point de fusion de 1024°C. Il est également paramagnétique et s'assombrit rapidement à l'air libre en formant des oxydes. Il est également paramagnétique et s'assombrit rapidement lorsqu'il est exposé à l'air, en formant des oxydes. Il réagit lentement à l'eau froide et rapidement à l'eau chaude.
Le grenat d'aluminium et d'yttrium dopé au néodyme et le verre de néodyme peuvent remplacer le rubis comme matériaux laser, tandis que le verre de néodyme et de praséodyme peut servir de lunettes.
Le néodyme est un élément crucial de l'industrie des terres rares et joue un rôle important dans la régulation du marché des terres rares.

Le samarium est un élément métallique dont le symbole chimique est Sm et le numéro atomique 62. Il a une couleur blanc argenté, une dureté moyenne et est susceptible de s'oxyder lorsqu'il est exposé à l'air.
En tant que représentant de la série des lanthanides, le samarium existe généralement dans un état d'oxydation de +3. Les composés de samarium les plus répandus sont SmO, SmS, SmI2 et SmTe.
Le samarium n'a pas d'effets biologiques significatifs et ne présente qu'une faible toxicité.

L'europium est un élément métallique de couleur blanc argenté qui peut être oxydé en un oxyde presque blanc. Son point de fusion est de 822°C, son point d'ébullition de 1597°C et sa densité de 5,2434 g/cm³.
Parmi les terres rares, l'europium est le plus doux et le plus volatil, et c'est aussi le métal le plus réactif. Exposé à l'air à température ambiante, il perd son éclat métallique et s'oxyde rapidement en poudre.
L'europium réagit violemment avec l'eau froide, produisant de l'hydrogène. En outre, il peut réagir avec le bore, le carbone, le soufre, le phosphore, l'hydrogène et l'azote.
L'europium a de nombreuses applications pratiques. Il est largement utilisé dans la production de matériaux de contrôle des réacteurs et de protection contre les neutrons, ainsi que dans l'industrie de l'énergie atomique en tant que phosphore pour la télévision couleur et dans la production de matériaux laser à l'europium (Eu).
L'europium est l'une des terres rares les plus rares de la planète, avec une teneur de seulement 1,1 ppm. Il s'agit d'un métal doux, brillant, gris acier, très ductile et malléable, ce qui lui permet d'être facilement transformé en diverses formes. Il ressemble au plomb en apparence et au toucher, mais il est légèrement plus lourd.

Le gadolinium est un élément métallique représenté par le symbole Gd, avec un numéro atomique de 64 et un poids atomique de 157,25. Il a un aspect blanc argenté et est de nature ductile. L'élément porte le nom du scientifique finlandais Gadolin, qui a contribué de manière significative à l'étude des lanthanides.
Le gadolinium a été isolé pour la première fois en 1880 à Malaya, en Suisse, et sa forme pure a été préparée et nommée par le chimiste français Bouvabodrand en 1886. On le trouve principalement dans des minéraux tels que la monazite et la bastnaesite, et son abondance dans la croûte terrestre n'est que de 0,000636%.
Le gadolinium a un large éventail d'applications dans des domaines tels que la médecine, l'industrie et la technologie nucléaire, entre autres.

Le terbium fait partie de la série des lanthanides et est représenté par le symbole chimique Tb, avec un numéro atomique de 65. Il fait partie du groupe III de la sixième période du tableau périodique et a un aspect métallique blanc argenté sous sa forme élémentaire.
En tant que métal de terre rare, le terbium est toxique et ne possède qu'un seul isotope stable à l'état naturel, ainsi que 20 autres radio-isotopes. Il possède une structure cristalline hexagonale et se dissout dans l'acide dilué, mais réagit lentement avec l'eau.
En raison de sa forte réactivité, le terbium doit être stocké dans un récipient rempli d'un gaz inerte ou dans un récipient sous vide.
Le dysprosium est un métal doux, blanc argenté, représenté par le symbole chimique Dy. Il a un point de fusion de 1412°C, un point d'ébullition de 2562°C et une densité de 8,55g/cm³. Il est même capable de présenter une supraconductivité proche du zéro absolu.
Bien que le dysprosium soit relativement stable lorsqu'il est exposé à l'air, il peut être facilement oxydé par l'air et l'eau à des températures élevées, ce qui entraîne la formation d'oxyde de dysprosium.
Le dysprosium trouve de nombreuses applications dans divers domaines, notamment la fabrication de nouvelles sources d'éclairage comme les lampes au dysprosium, comme matériau de contrôle dans les réacteurs et comme catalyseur dans l'industrie du raffinage du pétrole sous la forme de composés de dysprosium.

Le holmium est un élément métallique dont le symbole chimique est Ho, le numéro atomique 67 et le poids atomique 164,93. Il a été nommé d'après la ville natale de son découvreur, Stockholm, qui l'a identifié pour la première fois dans le spectre de la terre d'erbium en 1878. L'année suivante, le Suédois Clive a séparé l'holmium de la terre d'erbium par des méthodes chimiques.
La concentration d'holmium dans la croûte terrestre est de 0,000115%, et on le trouve dans la monazite et les minerais de terres rares, avec d'autres éléments de terres rares. L'holmium-165 est le seul isotope stable de l'holmium. Il s'agit d'un métal blanc argenté, mou et ductile, dont le point de fusion est de 1474°C, le point d'ébullition de 2695°C et la densité de 8,7947 g/cm³.
Bien que l'holmium soit stable dans l'air sec, il s'oxyde rapidement à haute température. L'oxyde d'holmium est la substance la plus paramagnétique connue, et les composés d'holmium peuvent être utilisés comme additifs pour de nouveaux matériaux ferromagnétiques. L'iodure d'holmium est utilisé pour fabriquer des lampes aux halogénures métalliques, telles que les lampes à l'holmium, et les lasers à l'holmium sont largement utilisés dans le domaine médical.

L'erbium est un élément du tableau périodique dont le symbole est Er et le numéro atomique 68. Il appartient à la série des lanthanides et se situe dans le groupe III B de la 6e période, avec un poids atomique de 167,26. Le nom de l'élément provient du lieu de sa découverte, la terre d'yttrium.
L'oxyde d'erbium a été découvert pour la première fois dans la terre d'yttrium par le scientifique suédois Mossander en 1843 et a été officiellement nommé en 1860. La teneur en erbium de la croûte terrestre est de 0,000247%, et il est présent dans de nombreux minéraux de terres rares. Il existe six isotopes naturels de l'erbium, à savoir 162, 164, 166, 167, 168 et 170.

Le thulium est un métal doux, blanc argenté, dont le symbole chimique est TM. Il est malléable et peut être facilement coupé avec un couteau. Le thulium a un point de fusion de 1545°C, un point d'ébullition de 1947°C et une densité de 9,3208.
Il est relativement stable dans l'air et sa forme d'oxyde se présente sous la forme d'un cristal vert clair. Le thulium a un numéro atomique de 69 et un poids atomique de 168,93421. Le nom de l'élément provient du pays où il a été découvert.
Le thulium est le moins abondant des éléments de terres rares, avec une concentration dans la croûte terrestre de seulement 2 parties pour 100 000. On le trouve principalement dans les minerais d'yttrium-phosphore et dans les mines de terres rares noires. Le seul isotope naturel stable du thulium est le 169.
Le thulium a de nombreuses applications dans différents domaines, notamment les sources de lumière à haute intensité pour la production d'électricité, les lasers, les supraconducteurs à haute température, etc.

L'ytterbium est un élément métallique dont le symbole chimique est Yb, le numéro atomique 70 et le poids atomique 173,04. Son nom provient de l'endroit où il a été découvert.
La concentration d'ytterbium dans la croûte terrestre est de 0,000266%. On le trouve principalement dans les minerais d'yttrium-phosphore et dans les mines de terres rares noires. Il existe sept isotopes naturels de l'ytterbium.
Le lutécium est un élément métallique dont le symbole chimique est Lu. C'est un métal blanc argenté, le plus dur et le plus dense de toutes les terres rares, avec un point de fusion de 1663°C, un point d'ébullition de 3395°C et une densité de 9,8404. Le lutécium est relativement stable dans l'air, et sa forme oxyde est un cristal incolore qui se dissout dans l'acide pour former un sel incolore correspondant.
Bien que les réserves naturelles de lutécium soient limitées, il est utilisé à plusieurs reprises, principalement à des fins de recherche. Il est soluble dans les acides dilués et réagit lentement avec l'eau. Ses sels sont incolores et ses oxydes sont blancs. Les deux isotopes naturels du lutécium sont le 175Lu, dont la demi-vie est de 2,1 x 1010 ans, et 176Lu.
En raison de ses réserves naturelles limitées, le lutécium est un élément coûteux.

Le scandium est un élément chimique de symbole Sc et de numéro atomique 21. Il s'agit d'un métal de transition doux, blanc argenté, parfois allié au gadolinium et à l'erbium.
La production de scandium est très limitée et sa concentration dans la croûte terrestre est d'environ 0,0005%. Il est couramment utilisé dans la production de verres spécialisés et d'alliages légers et résistants à la chaleur.

L'yttrium est un métal gris-noir identifié par le symbole chimique Y. Il est considéré comme le premier élément métallique de terre rare découvert et est connu pour sa ductilité. L'yttrium réagit facilement à l'eau chaude et peut être dissous dans des acides dilués. En outre, il est utilisé dans la production de verres et d'alliages spéciaux.

Le thorium est un élément métallique radioactif identifié par le symbole chimique Th. Son potentiel en tant que combustible nucléaire réside dans sa capacité à se transformer en uranium 233 lorsqu'il est soumis à un bombardement de neutrons. Le thorium a une texture douce et un éclat gris et se caractérise par ses propriétés chimiques actives. Il est largement répandu dans la croûte terrestre et est considéré comme une matière énergétique prometteuse pour ses applications potentielles dans le domaine de l'énergie nucléaire.

Le hafnium est un élément métallique dont le symbole chimique est Hf, le numéro atomique 72 et le poids atomique 178,49. À l'état pur, il se présente sous la forme d'un métal de transition brillant, gris argenté. Il existe six isotopes stables du hafnium dans la nature : hafnium-174, hafnium-176, hafnium-177, hafnium-178, hafnium-179 et hafnium-180.
Le hafnium est relativement peu réactif et ne réagit pas avec l'acide chlorhydrique dilué, l'acide sulfurique dilué ou les solutions alcalines fortes. Il est toutefois soluble dans l'acide fluorhydrique et l'eau régale. La concentration de hafnium dans la croûte terrestre est relativement faible, puisqu'elle n'est que de 0,00045%. Dans la nature, on le trouve souvent associé au zirconium.

Le silicium, également connu sous son ancien nom de silicium, est un élément chimique représenté par le symbole Si. D'un numéro atomique de 14 et d'une masse atomique relative de 28,0855, il existe sous deux formes : le silicium amorphe et le silicium cristallin.
Dans le tableau périodique, le silicium se situe dans la troisième période et est classé comme un élément métalloïde dans le groupe IVA. Il s'agit d'un élément très abondant, qui occupe la huitième place dans l'univers.
Malgré son abondance, le silicium pur est rare dans la nature. On le trouve généralement dans les silicates complexes ou la silice présents dans les roches, les graviers et la poussière.
Le silicium est le deuxième élément le plus abondant dans la croûte terrestre, représentant 26,4% de la masse totale. L'oxygène est l'élément le plus abondant, représentant 49,4% de la croûte.

Le sélénium est un non métallique élément représenté par le symbole chimique Se. Il fait partie du groupe VIa de la quatrième période du tableau périodique des éléments (élément 34). Le sélénium a de nombreuses applications, notamment en tant que matériau photosensible, catalyseur dans l'industrie du manganèse électrolytique, nutriment essentiel pour les animaux et nutriment bénéfique pour les plantes.
Dans la nature, le sélénium existe sous deux formes : le sélénium inorganique et le sélénium végétal. Le sélénium inorganique est composé de sélénite et de sélénate de sodium, qui sont obtenus à partir de sous-produits de gisements de métaux.
Le sélénium actif dans les plantes, quant à lui, résulte de la combinaison de sélénium et d'acides aminés par biotransformation. Il est souvent présent sous forme de sélénométhionine.

Le sélénium est un élément non métallique représenté par le symbole chimique Se. Il appartient au groupe VIa du tableau périodique des éléments et se situe dans la quatrième période en tant qu'élément 34. Le sélénium a de multiples applications, notamment comme matériau photosensible, comme catalyseur dans l'industrie du manganèse électrolytique, comme nutriment vital pour les animaux et comme nutriment bénéfique pour les plantes.
Dans la nature, le sélénium se présente sous deux formes : le sélénium inorganique et le sélénium végétal. Le sélénium inorganique est obtenu comme sous-produit des gisements de métaux et comprend le sélénite de sodium et le sélénate de sodium.
D'autre part, le sélénium actif dans les plantes est produit par biotransformation en combinant le sélénium avec des acides aminés. On le trouve généralement sous la forme de sélénométhionine.

L'arsenic, également connu sous le nom d'As, est un élément non métallique appartenant au groupe VA de la quatrième période du tableau périodique des éléments. Il a un numéro atomique de 33 et existe sous trois formes allotropiques différentes : l'arsenic gris, l'arsenic noir et l'arsenic jaune.
Cet élément est très répandu dans la nature et de nombreux minéraux contenant de l'arsenic ont été découverts. L'arsenic et ses composés sont utilisés à diverses fins, notamment dans les pesticides, les herbicides, les insecticides et les alliages. Toutefois, son composé, le trioxyde d'arsenic, est hautement toxique.

Le bore, représenté par le symbole B, est un élément chimique présent dans la croûte terrestre avec une concentration de seulement 0,001%. Il se présente généralement sous la forme de solides noirs ou gris argentés avec une structure cristalline noire. Sa dureté n'est surpassée que par celle du diamant, mais sa texture est cassante.
Ce qui distingue le bore des autres éléments, c'est son nombre de coordination exceptionnellement élevé dans son hydrure, qui résulte de sa carence en électrons. C'est pourquoi il possède les hydrures élémentaires les plus complexes.

Le radium, symbolisé par Ra, est un élément hautement radioactif qui appartient à la 7e période, au groupe IIA, et dont le numéro atomique est 88 dans le tableau périodique des éléments.
Bien que le radium métal pur soit presque incolore, il réagit avec l'azote de l'air pour former du nitrure de radium noir (Ra3N2).
Tous les isotopes du radium présentent une forte radioactivité, le radium 226 étant l'isotope le plus stable. Il a une demi-vie d'environ 1600 ans et se désintègre en radon-222.
La désintégration du radium produit un rayonnement ionisant qui fait briller les substances fluorescentes.
On attribue à Mme Curie la découverte du radium, qui a apporté des contributions importantes à la science.
Le francium est un élément radioactif désigné par le symbole chimique Fr et dont le numéro atomique est 87. Il est formé par la désintégration alpha de l'actinium 227 et peut être trouvé en petites quantités dans la nature.
Les 21 isotopes du francium actuellement connus sont tous radioactifs et présentent des demi-vies très courtes. Parmi eux, le francium-223 a la demi-vie la plus longue (21 minutes) et émet des particules bêta. Les trois autres isotopes ayant des demi-vies relativement plus longues sont le francium-212, le francium-222 et le francium-221, avec des demi-vies respectives de 19,3, 14,8 et 4,8 minutes.
Le polonium est l'un des éléments les plus rares connus de l'homme. Son symbole chimique est Po et son numéro atomique est 84. Sa concentration dans la croûte terrestre est d'environ un cent trillionième et il est principalement obtenu par synthèse artificielle.
Le polonium, métal blanc argenté, émet une lueur dans l'obscurité. Il a été découvert en 1898 par les célèbres scientifiques Madame Curie et son mari Pierre Curie, et a été nommé d'après le pays d'origine de Madame Curie, la Pologne.
Le polonium est également connu pour être l'une des substances les plus toxiques au monde.

L'uranium est un élément dont le numéro atomique est 92 et le symbole U. C'est l'élément naturel le plus lourd.
Il existe trois isotopes d'uranium dans la nature, qui sont tous radioactifs et ont des demi-vies très longues, allant de centaines de milliers d'années à 4,5 milliards d'années.

Le plutonium est un élément radioactif dont le numéro atomique est 94 et le symbole Pu. Il s'agit d'une matière première essentielle pour l'industrie de l'énergie atomique et il a diverses applications, notamment son utilisation comme combustible nucléaire et comme agent fissile dans les armes nucléaires. Le cœur de la bombe atomique larguée sur Nagasaki était constitué de plutonium. Le plutonium a été synthétisé pour la première fois au Laboratoire national des États-Unis en décembre 1940.
Les métaux ferreux sont des métaux dont le principal constituant est le fer, tandis que les métaux non ferreux sont des métaux dont le principal constituant n'est pas le fer. Cette différence de composition confère à ces deux types de métaux des propriétés et des caractéristiques différentes.
Le métal le plus utilisé dans le monde est le fer. Le fer est largement utilisé dans la construction, le transport et la fabrication en raison de sa résistance, de sa durabilité et de son faible coût. Les autres métaux couramment utilisés sont l'aluminium, le cuivre et l'acier.
Les métal le plus résistant connue est actuellement tungstèneLe tungstène, également connu sous le nom de wolfram, présente une résistance à la traction pouvant atteindre 1 510 mégapascals (MPa). Le tungstène possède le point de fusion le plus élevé de tous les métaux, ainsi qu'une excellente résistance à la corrosion, ce qui en fait un matériau très prisé dans diverses industries, notamment l'aérospatiale, la défense et l'électronique. Il existe toutefois d'autres matériaux dont la résistance à la traction est supérieure à celle du tungstène, comme les nanotubes de carbone et le graphène, mais il ne s'agit pas de métaux.
Le métal le plus cher au monde est actuellement le rhodium. En mars 2023, le rhodium se négocie à environ $20 000 l'once troy, ce qui le rend plus de 10 fois plus cher que l'or. Le rhodium est un métal rare, blanc argenté, qui est principalement utilisé dans les convertisseurs catalytiques des automobiles et dans d'autres applications industrielles, ainsi que dans la bijouterie et d'autres objets décoratifs. Le platine, l'or et le palladium sont d'autres métaux coûteux.
Les métaux magnétiques comprennent le fer, le nickel, le cobalt, l'acier, l'acier inoxydable et les terres rares. Certains de ces matériaux présentent un magnétisme permanent, tandis que d'autres, comme l'acier inoxydable, ne présentent un magnétisme que s'ils possèdent une composition chimique particulière.
Le fer
Le fer est le métal ferromagnétique le plus puissant et c'est lui qui confère à la Terre son champ magnétique. C'est un composant essentiel du noyau de la planète.
Nickel
Le nickel est également un métal magnétique courant aux propriétés ferromagnétiques. Le nickel a toujours été utilisé pour fabriquer des pièces de monnaie.
Cobalt
Le cobalt est un métal ferromagnétique qui a été largement utilisé au cours du siècle dernier en raison de ses propriétés magnétiques exceptionnelles. Il convient à la production d'aimants doux et durs.
Acier
L'acier est ferromagnétique en raison de sa teneur en fer, ce qui fait qu'il est souvent attiré par les aimants. En outre, l'acier est capable de produire des aimants permanents.
Acier inoxydable
L'acier inoxydable est un acier allié L'acier inoxydable est fabriqué en ajoutant du chrome au mélange. Certains types d'acier inoxydable présentent des propriétés magnétiques, d'autres non. Les propriétés magnétiques des aciers inoxydables ferritiques et martensitiques sont influencées par leur composition et leur structure moléculaire.
La teneur en nickel est le principal facteur expliquant les variations des propriétés magnétiques entre les différents types d'acier inoxydable.
Métaux de terres rares
L'acier inoxydable est un alliage d'acier créé en ajoutant du chrome au métal de base. Cependant, tous les types d'acier inoxydable ne sont pas magnétiques, et les propriétés magnétiques de l'acier ferritique et de l'acier inoxydable sont différentes. acier inoxydable martensitique sont le résultat de leur composition chimique et de leur structure moléculaire.
La quantité de nickel présente dans l'acier inoxydable est le principal facteur à l'origine des variations des propriétés magnétiques entre les différents types d'acier inoxydable.
Seul un nombre limité de métaux du tableau périodique présente des propriétés magnétiques. En revanche, la majorité des métaux couramment utilisés, tels que l'aluminium, l'or, l'argent et le cuivre, ne sont pas magnétiques.
Aaluminium
La structure cristalline de l'aluminium est similaire à celle du lithium et du magnésium, ce qui le rend non magnétique. Ces trois matériaux sont classés parmi les métaux paramagnétiques.
Gancien
Comme d'autres métaux, l'or est diamagnétique, ce qui signifie qu'il exerce une légère attraction magnétique sur les aimants puissants. Cette caractéristique est commune à tous les métaux diamagnétiques, y compris l'or.
Silver
L'argent est un autre métal non magnétique. Le diamagnétisme de l'argent le rend non magnétique.
Copper
Le cuivre n'est pas magnétique par nature, mais il peut interagir avec les aimants de plusieurs manières, notamment en créant des courants de Foucault. Les centrales électriques tirent parti de cette propriété du cuivre pour produire de l'électricité.
Les métaux lourds comprennent le mercure, le plomb, le cadmium, l'or, l'argent, le cuivre et le fer.
Les métaux lourds sont des métaux dont la densité est supérieure à 4,5 g/cm3. Ils sont très résistants à la biodégradation et peuvent s'accumuler dans la chaîne alimentaire, entraînant un enrichissement au centuple de l'environnement.
Lorsque les métaux lourds pénètrent dans le corps humain par le biais des aliments, ils peuvent perturber les fonctions physiologiques normales et constituer une menace pour la santé humaine. Ces types de métaux lourds sont appelés métaux lourds toxiques.
En termes de pollution environnementale, les métaux lourds désignent principalement des éléments lourds présentant une toxicité biologique importante, tels que le mercure, le cadmium, le plomb, le chrome et l'arsenic métalloïde.
Les métaux lourds ont le potentiel d'interagir fortement avec les protéines et les enzymes du corps humain, les rendant inactifs. En outre, ils peuvent s'accumuler dans des organes spécifiques, entraînant un empoisonnement chronique.
Le métal le plus précieux au monde est le plutonium, qui coûte $113400 USD l'once..
Le plutonium est un métal radioactif utilisé dans la production de pastilles de combustible pour les centrales nucléaires, ainsi que comme ingrédient dans la création d'armes nucléaires.
Pourquoi le plutonium est-il si cher ?
Le plutonium est un élément rare que l'on trouve généralement en petites quantités dans le minerai d'uranium dans la nature. Cependant, la majorité du plutonium est produite comme sous-produit de l'industrie de l'énergie nucléaire, par l'irradiation de l'uranium dans les réacteurs. On estime qu'environ 20 tonnes de plutonium sont générées chaque année par ce processus.
En raison de ses applications limitées, notamment l'énergie nucléaire, les armes et la recherche scientifique, et des risques potentiels qu'il présente pour l'homme en cas de mauvaise manipulation, le plutonium est soumis à des réglementations strictes et il est difficile de se le procurer. En outre, son acquisition peut s'avérer très coûteuse.
L'aluminium est l'élément métallique le plus concentré dans la croûte terrestre, représentant 7,73% du total. Le calcium est l'élément métallique le plus concentré dans le corps humain, avec 1,5% de sa composition. Le fer est actuellement le métal dont la production annuelle est la plus élevée au niveau mondial.
L'hydrogène est le métal ayant la plus faible densité et est devenu le métal le plus léger après que des scientifiques de l'université d'Édimbourg ont produit de l'hydrogène métallique pour la première fois en janvier 2016. L'osmium a la densité la plus élevée de tous les métaux, avec une densité de 22,48 × 10³ kg/m³.
Le chrome est le métal le plus dur avec un Dureté Mohs d'environ 9, tandis que le césium est le métal le plus mou avec une dureté de Mohs d'environ 0,5. L'argent est le métal le plus conducteur.
Le titane est considéré comme le métal le plus important pour la fabrication d'avions à grande vitesse et les scientifiques l'appellent "le métal du 21e siècle" ou "l'acier du futur". L'uranium est le plus grand élément radioactif présent dans l'eau de mer. Les réserves totales des mines d'uranium terrestres sont estimées à 2 millions de tonnes et la quantité totale d'uranium dans l'océan est estimée à 4 millions de tonnes.
L'étain possède le plus grand nombre d'isotopes, avec 10 isotopes stables, tandis que le sodium ne possède qu'un seul isotope stable, Na-23.
L'or est le métal le plus malléable, qui peut être transformé en feuilles d'une épaisseur de 1/10000 mm. Le platine est le métal le plus ductile, qui peut être étiré en fils d'un diamètre aussi fin que 1/5000 mm.
Le tungstène a le point de fusion le plus élevé de tous les métaux, avec une température de fusion de 3410℃, alors que le mercure a le point de fusion le plus bas, fondant à -38,8℃. Le gallium a la plus grande différence entre son point de fusion (30℃) et son point d'ébullition (2403℃). Le Francium a la plus faible concentration dans la croûte terrestre, avec une teneur de seulement 37 par tonne × 10-13g, soit environ 1 × 10-21%.
Le césium est le métal qui réagit le plus à la lumière et qui génère le courant le plus important. Lorsque sa surface est éclairée, les électrons peuvent gagner de l'énergie et s'échapper de la surface, ce qui produit un courant photoélectrique. Le césium possède également les plus grandes propriétés métalliques de tous les métaux.
Le californium est le métal le plus cher au monde, avec un prix de $10 millions de dollars américains par gramme, ce qui le rend plus de 500 000 fois plus cher que l'or. Le fer est le métal le moins cher.
Le niobium est l'élément supraconducteur le plus pratique, devenant un supraconducteur presque sans résistance lorsqu'il est refroidi à -263,9℃. Le palladium possède la plus grande capacité d'absorption de gaz, un volume de palladium colloïdal pouvant absorber jusqu'à 1 200 volumes d'hydrogène.
Il n'est pas toujours possible de savoir si un métal est toxique simplement en le regardant ou en le manipulant. Certains métaux peuvent être toxiques sous certaines formes ou à certaines concentrations, tandis que d'autres peuvent ne pas l'être du tout.
La toxicité d'un métal dépend de facteurs tels que la forme du métal (solide, liquide, gaz), la concentration ou la dose d'exposition, et la voie d'exposition (inhalation, ingestion, contact avec la peau).
Pour déterminer la toxicité d'un métal, il est important de consulter des sources fiables telles que la fiche de données de sécurité (FDS) ou d'autres directives de sécurité. Ces sources fournissent des informations sur les dangers et les précautions associés au métal, ainsi que des conseils pour une manipulation, un stockage et une élimination en toute sécurité.
Il est également important de respecter les procédures de sécurité appropriées lors de la manipulation de tout métal, comme le port d'équipements de protection tels que des gants, des lunettes et des respirateurs, et d'éviter tout contact direct avec le métal dans la mesure du possible.
Sur les 118 éléments connus du tableau périodique, environ 90 sont considérés comme des métaux. Le nombre exact dépend de la classification de certains éléments limites (présentant à la fois des caractéristiques de métal et de non-métal).