Qu'est-ce qui rend les métaux si polyvalents et indispensables dans l'ingénierie ? Cet article explore les bases essentielles de la cristallisation, de la structure et des transformations des métaux. Découvrez comment les métaux passent de l'état liquide à l'état solide, l'importance des défauts cristallins et le phénomène fascinant de la surfusion. En comprenant ces principes, vous comprendrez mieux les propriétés des métaux et leurs applications dans diverses industries.
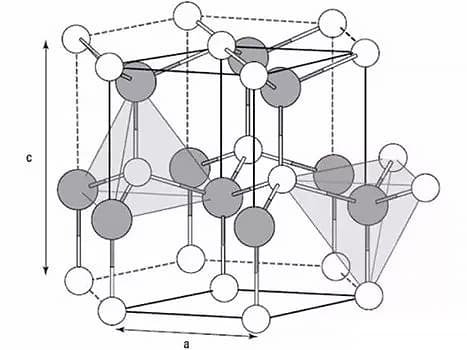
Les métaux sont des cristaux à l'état solide.
La structure cristalline est liée aux propriétés, à la déformation plastique et aux transformations de phase du traitement thermique des métaux.
Les trois réseaux les plus courants dans les métaux sont le réseau cubique centré sur le corps, le réseau cubique centré sur la face et le réseau hexagonal serré.
Les défauts des cristaux peuvent être classés en trois catégories en fonction de leur forme géométrique : les défauts ponctuels, les défauts linéaires et les défauts plans.
Le processus par lequel un métal passe de l'état liquide à l'état solide (cristallin) est connu sous le nom de cristallisation du métal.
(1) Courbe de refroidissement et le phénomène de surfusion
La courbe de refroidissement est un graphique qui montre la relation entre la température et le temps pendant le processus de refroidissement d'un matériau. La courbe de refroidissement d'un cristal métallique peut être déterminée à l'aide de méthodes d'analyse thermique. Le processus consiste à faire fondre le métal pour obtenir une température aussi uniforme que possible, à le refroidir à une vitesse déterminée, à enregistrer les variations de température dans le temps et à reporter les données sur un graphique température-temps pour obtenir la courbe de refroidissement, comme le montre la figure 1.
La chaleur latente de cristallisation libérée pendant la cristallisation s'oppose à la perte de chaleur du métal vers l'extérieur, ce qui fait apparaître une ligne horizontale sur la courbe de refroidissement. La température correspondant à cette ligne est la température de cristallisation réelle du métal.
Les expériences montrent que la température de cristallisation réelle (T1) du métal est toujours inférieure à la température de cristallisation théorique (T0). Ce phénomène est appelé surfusion. La surfusion est une condition nécessaire à la cristallisation. La différence entre T0 et T1, △T = T0 - T1, est appelée degré de surfusion.
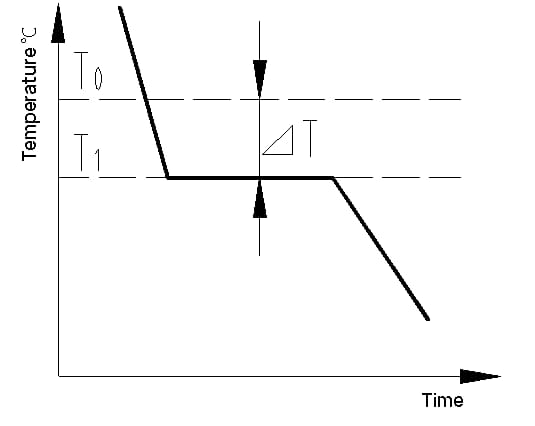
Fig. 1 Courbe de refroidissement d'un cristal de fer pur
(2) Processus de cristallisation
Le processus de cristallisation implique la création et l'expansion de noyaux. Ce processus est connu sous le nom de nucléation et croissance.
Le phénomène par lequel un métal passe d'une structure de réseau à une autre lorsque la température change à l'état solide est connu sous le nom de transformation isomorphe.
Parmi les métaux qui subissent cette transformation figurent le fer et le cobalt, titanel'étain et le manganèse.
Les cristaux d'un même élément métallique qui existent sous différentes formes de réseau sont appelés cristaux allotropiques du métal.
Phase : Les composants uniformes d'un alliage (ou d'un métal pur) qui possèdent la même composition, la même structure et les mêmes propriétés, et qui sont séparés les uns des autres par une interface.
La structure de phase des alliages peut être divisée en deux types en fonction de l'interaction entre les éléments constitutifs : la solution solide et le composé métallique.
(1) Solution solide : Lorsque l'alliage liquide se solidifie, les éléments peuvent encore se dissoudre les uns dans les autres pour former une phase dans laquelle les atomes d'un élément sont dispersés dans le réseau d'un autre élément. Cette phase est connue sous le nom de solution solide.
(2) Composé métallique.
Le diagramme de phase d'un alliage, également connu sous le nom de diagramme d'équilibre d'un alliage ou de diagramme d'état d'un alliage, est un diagramme qui illustre la relation entre la température, la composition et l'état d'un alliage dans des conditions d'équilibre. Il décrit les lois de changement structurel des alliages de composition variable lorsqu'ils sont lentement refroidis ou chauffés à l'infini.
Le diagramme de phase de l'alliage est un outil important pour sélectionner la bonne composition de l'alliage, analyser la microstructure de l'alliage, étudier ses propriétés et déterminer les procédés de moulage, de forgeage et de traitement thermique.
(1) Diagramme de phase homogène : Ce type de diagramme représente un système d'alliage où deux composants peuvent être infiniment miscibles à l'état liquide et à l'état solide. Au cours de la solidification, l'alliage forme une solution solide à partir de la phase liquide, un processus connu sous le nom de transformation homogène.
(2) Diagramme de phase eutectique : Dans ce diagramme, deux composants sont complètement miscibles à l'état liquide et présentent une transformation eutectique. La transformation eutectique désigne la cristallisation simultanée de deux phases solides ayant une composition spécifique à partir d'une phase liquide uniforme ayant une composition spécifique à une température donnée.
(3) Diagramme de phase péritectique : Dans ce diagramme, deux composants sont infiniment miscibles à l'état liquide et forment une solution solide finie à l'état solide. Il existe également un état de transformation péritectique. La transformation péritectique désigne la réaction entre la phase liquide d'un certain composant et la phase solide d'un autre composant, qui aboutit à la formation d'une nouvelle phase solide à température constante.

L'acier est un alliage de fer et de carbone dont la composition est spécifique.
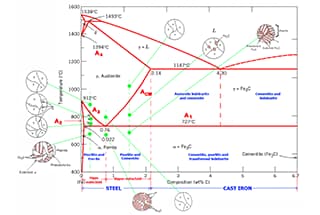
Le diagramme de phase des alliages fer-carbone illustre les différentes structures d'équilibre des alliages fer-carbone de compositions variées à différentes températures, comme le montre le diagramme de phase Fe-Fe3C.
Le diagramme de phase Fe-Fe3C permet de déterminer la température à laquelle se produit la transformation de phase dans un alliage fer-carbone d'une certaine composition, également appelée point critique.
En analysant le diagramme de phase Fe-Fe3C, il est possible de prédire le processus de transformation de phase dans différentes régions de température et la structure d'équilibre potentielle après refroidissement à température ambiante.
Reportez-vous aux points caractéristiques du diagramme de phase Fe-Fe3C pour une description de chaque point du diagramme de phase de l'alliage fer-carbone et aux lignes caractéristiques pour une description de chaque ligne.
Selon le diagramme de phase de l'alliage fer-carbone, l'acier au carbone avec teneur en carbone inférieure à 2.11% et la fonte dont la teneur en carbone est supérieure à 2.11% sont différenciées.
Sur la base des caractéristiques structurelles, l'alliage fer-carbone est divisé en sept catégories en fonction de la teneur en carbone dans le diagramme de phase de l'alliage fer-carbone :
(1) Fer industriel pur, avec une teneur en carbone < 0,0218% ;
(2) Acier eutectoïde, avec une teneur en carbone de 0,77% ;
(3) Acier hypoeutectoïde, dont la teneur en carbone est comprise entre 0,0218% et 0,77% ;
(4) Acier hypereutectoïde, avec une teneur en carbone comprise entre 0,77% et 2,11% ;
(5) Fonte blanche eutectique, avec une teneur en carbone de 4.30% ;
(6) Fonte blanche sous-cristalline, avec une teneur en carbone comprise entre 2,11% et 4,30% ;
(7) Fonte blanche super cristalline, avec une teneur en carbone comprise entre 4,30% et 6,69%.
Métal : Matériau présentant une bonne conductivité thermique et électrique, caractérisé par son aspect opaque et son éclat métallique. La conductivité des métaux diminue avec l'augmentation de la température, et ils sont connus pour leur ductilité et leur extensibilité.
Un cristal métallique est un solide dans lequel les atomes sont disposés de manière régulière.
Alliage : Substance aux propriétés métalliques composée de deux éléments ou plus, y compris des métaux et des non-métaux.
Renforcement de la solution solide : Ce phénomène se produit lorsque les atomes du soluté occupent les espaces ou les interstices du réseau du solvant, ce qui entraîne une distorsion du réseau et une augmentation de la résistance de la solution solide. dureté et résistance de la solution solide.
Composé : Une nouvelle structure solide cristalline avec des propriétés métalliques est formée par la combinaison des composants de l'alliage.
Mélange mécanique : Une composition d'alliage composée de deux structures cristallines distinctes, même si elle apparaît comme une entité unique avec des propriétés mécaniques indépendantes.
Ferrite : Solution solide interstitielle de carbone dans l'alpha-Fe (fer cubique centré sur le corps).
Austenite: Solution solide interstitielle de carbone dans le gamma-Fe (fer cubique à faces centrées).
Cémentite : Composé stable (Fe3C) formé par la combinaison du carbone et du fer.
Pearlite : Mélange mécanique composé de ferrite et de cémentite (F + Fe3C, contenant 0,8% de carbone).
Lédéburite : Mélange mécanique composé de cémentite et de austénite (contenant 4,3% de carbone).

Le traitement thermique des métaux est un processus crucial dans la fabrication mécanique. Contrairement à d'autres méthodes de traitement, le traitement thermique ne modifie pas la forme ou la composition chimique globale de la pièce, mais améliore ses performances en modifiant sa microstructure ou la composition chimique de sa surface.
Le traitement thermique a pour but d'améliorer la qualité interne de la pièce, qui n'est souvent pas visible à l'œil nu. Pour obtenir les propriétés mécaniques, physiques et chimiques souhaitées d'une pièce métallique, le traitement thermique est souvent nécessaire, en plus de la sélection appropriée des matériaux et des différents procédés de fabrication. procédés de formage.
L'acier est le matériau le plus utilisé dans l'industrie mécanique, et sa microstructure peut être contrôlée par un traitement thermique. Par conséquent, le traitement thermique de l'acier est un aspect majeur du traitement thermique des métaux.
Outre l'acier, le traitement thermique peut également être utilisé pour modifier les propriétés mécaniques, physiques et chimiques de l'aluminium, du cuivre, du magnésium, du titane et de leurs alliages, ce qui permet d'obtenir diverses propriétés de service.