Cosa rende i metalli così versatili e indispensabili in ingegneria? Questo articolo esplora le basi essenziali della cristallizzazione, della struttura e delle trasformazioni dei metalli. Scoprite come i metalli passano dallo stato liquido a quello solido, l'importanza dei difetti cristallini e l'affascinante fenomeno del superraffreddamento. La comprensione di questi principi vi permetterà di capire le proprietà dei metalli e le loro applicazioni in vari settori.
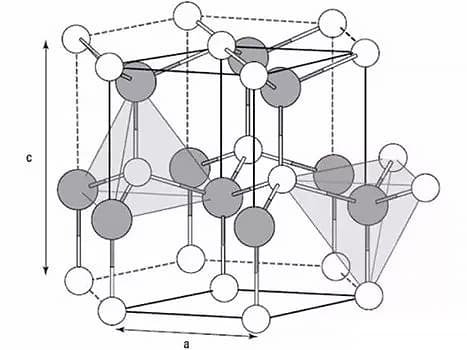
I metalli sono cristalli allo stato solido.
La struttura cristallina è correlata alle proprietà, alla deformazione plastica e alle trasformazioni di fase dei metalli durante il trattamento termico.
I tre reticoli più comuni nei metalli sono il reticolo cubico a corpo centrato, il reticolo cubico a facce centrate e il reticolo esagonale strettamente impacchettato.
I difetti dei cristalli possono essere classificati in tre categorie in base alla loro forma geometrica: difetti di punto, difetti di linea e difetti di piano.
Il processo di transizione di un metallo dallo stato liquido a quello solido (cristallino) è noto come cristallizzazione del metallo.
(1) Curva di raffreddamento e il fenomeno del superraffreddamento
La curva di raffreddamento è un grafico che mostra la relazione tra temperatura e tempo durante il processo di raffreddamento di un materiale. La curva di raffreddamento di un cristallo metallico può essere determinata con metodi di analisi termica. Il processo prevede la fusione del metallo per ottenere una temperatura il più possibile uniforme, il suo raffreddamento a una velocità prestabilita, la registrazione delle variazioni di temperatura nel tempo e la tracciatura dei dati su un grafico temperatura-tempo per ottenere la curva di raffreddamento, come mostrato nella Figura 1.
Il calore latente di cristallizzazione rilasciato durante la cristallizzazione contrasta la perdita di calore dal metallo verso l'esterno, facendo apparire una linea orizzontale sulla curva di raffreddamento. La temperatura corrispondente a questa linea è l'effettiva temperatura di cristallizzazione del metallo.
Gli esperimenti dimostrano che la temperatura di cristallizzazione effettiva (T1) del metallo è sempre inferiore alla temperatura di cristallizzazione teorica (T0). Questo fenomeno viene definito superraffreddamento. Il superraffreddamento è un requisito per la cristallizzazione. La differenza tra T0 e T1, △T = T0 - T1, è nota come grado di superraffreddamento.
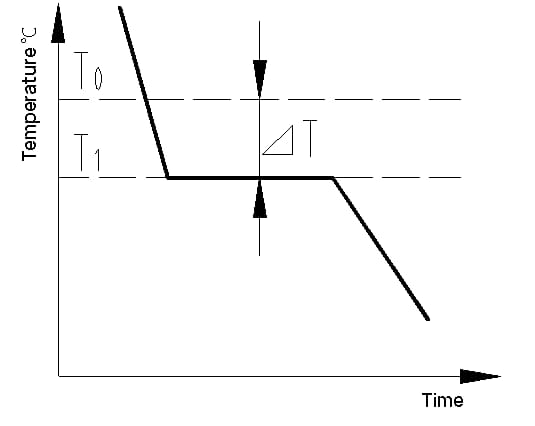
Fig. 1 curva di raffreddamento del cristallo di ferro puro
(2) Processo di cristallizzazione
Il processo di cristallizzazione comporta la creazione e l'espansione di nuclei. Questo processo è noto come nucleazione e crescita.
Il fenomeno per cui un metallo si trasforma da una struttura reticolare a un'altra al variare della temperatura allo stato solido è noto come trasformazione isomorfa.
Alcuni metalli che presentano questa trasformazione sono il ferro e il cobalto, titanio, stagno e manganese.
I cristalli dello stesso elemento metallico che esistono in forme reticolari diverse sono definiti cristalli allotropici del metallo.
Fase: Si riferisce ai componenti uniformi all'interno di una lega (o di un metallo puro) che possiedono la stessa composizione, struttura e proprietà e sono separati l'uno dall'altro da un'interfaccia.
La struttura delle fasi nelle leghe può essere suddivisa in due tipi in base all'interazione tra gli elementi costitutivi: soluzione solida e composto metallico.
(1) Soluzione solida: Quando la lega liquida si solidifica, gli elementi possono ancora dissolversi l'uno nell'altro per formare una fase in cui gli atomi di un elemento sono dispersi nel reticolo di un altro elemento. Questa fase è nota come soluzione solida.
(2) Composto metallico.
Il diagramma di fase della lega, noto anche come diagramma di equilibrio della lega o diagramma di stato della lega, è un diagramma che illustra la relazione tra temperatura, composizione e stato di una lega in condizioni di equilibrio. Rappresenta le leggi di cambiamento strutturale di leghe con composizioni diverse quando vengono lentamente raffreddate o riscaldate all'infinito.
Il diagramma di fase della lega è uno strumento importante per selezionare la giusta composizione della lega, analizzarne la microstruttura, studiarne le proprietà e determinare i processi di fusione, forgiatura e trattamento termico.
(1) Diagramma di fase omogeneo: Questo tipo di diagramma rappresenta un sistema di leghe in cui due componenti possono essere infinitamente miscibili sia allo stato liquido che solido. Durante la solidificazione, la lega forma una soluzione solida dalla fase liquida, un processo noto come trasformazione omogenea.
(2) Diagramma di fase eutettico: In questo diagramma, due componenti sono completamente miscibili allo stato liquido e presentano una trasformazione eutettica. La trasformazione eutettica si riferisce alla cristallizzazione simultanea di due fasi solide con una composizione specifica da una fase liquida uniforme con una composizione specifica a una particolare temperatura.
(3) Diagramma di fase peritettico: In questo diagramma, due componenti sono infinitamente miscibili allo stato liquido e formano una soluzione solida finita allo stato solido. Esiste anche uno stato di trasformazione peritettica. La trasformazione peritettica si riferisce alla reazione tra la fase liquida di un certo componente e la fase solida di un altro componente, che porta alla formazione di una nuova fase solida a temperatura costante.

L'acciaio è una lega di ferro e carbonio con una specifica gamma di composizione.
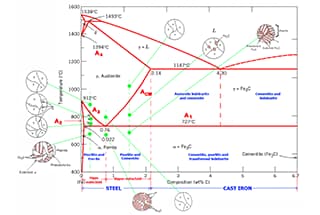
Il diagramma di fase delle leghe ferro-carbonio illustra le varie strutture di equilibrio delle leghe ferro-carbonio con composizioni variabili a diverse temperature, come rappresentato nel diagramma di fase Fe-Fe3C.
Dal diagramma di fase Fe-Fe3C, possiamo determinare la temperatura alla quale avviene la trasformazione di fase in una lega ferro-carbonio di una certa composizione, nota anche come punto critico.
Analizzando il diagramma di fase Fe-Fe3C, è possibile prevedere il processo di trasformazione di fase in diverse regioni di temperatura e la potenziale struttura di equilibrio al raffreddamento a temperatura ambiente.
Fare riferimento ai punti caratteristici del diagramma di fase Fe-Fe3C per una descrizione di ciascun punto del diagramma di fase della lega ferro-carbonio e alle linee caratteristiche per una descrizione di ciascuna linea.
Secondo il diagramma di fase delle leghe ferro-carbonio, l'acciaio al carbonio con contenuto di carbonio inferiore a 2,11% e ghisa con contenuto di carbonio superiore a 2,11%.
In base alle caratteristiche strutturali, la lega ferro-carbonio viene suddivisa in sette categorie in base al contenuto di carbonio nel diagramma di fase della lega ferro-carbonio:
(1) Ferro puro industriale, con contenuto di carbonio < 0,0218%;
(2) Acciaio eutettoide, con contenuto di carbonio 0,77%;
(3) Acciaio ipoeutettoide, con contenuto di carbonio compreso tra 0,0218% e 0,77%;
(4) Acciaio ipereutettoide, con contenuto di carbonio compreso tra 0,77% e 2,11%;
(5) Ghisa bianca eutettica, con contenuto di carbonio 4.30%;
(6) Ghisa bianca subcristallina, con contenuto di carbonio compreso tra 2,11% e 4,30%;
(7) Ghisa bianca supercristallina, con contenuto di carbonio compreso tra 4,30% e 6,69%.
Metallo: Materiale con buona conducibilità termica ed elettrica, caratterizzato da aspetto opaco e lucentezza metallica. La conducibilità dei metalli diminuisce all'aumentare della temperatura e sono noti per la loro duttilità ed espandibilità.
Un cristallo metallico è un solido in cui gli atomi sono disposti in modo regolare.
Lega: Sostanza con proprietà metalliche composta da due o più elementi, compresi metalli e non metalli.
Rafforzamento della soluzione solida: Si verifica quando gli atomi di soluto occupano gli spazi o gli interstizi del reticolo del solvente, causando la distorsione del reticolo e aumentando la resistenza della soluzione solida. durezza e resistenza della soluzione solida.
Composto: Dalla combinazione dei componenti della lega si forma una nuova struttura solida cristallina con proprietà metalliche.
Miscela meccanica: Una composizione di lega composta da due strutture cristalline distinte, anche se appare come un'entità singola con proprietà meccaniche indipendenti.
Ferrite: Soluzione solida interstiziale di carbonio in alfa-Fe (ferro cubico centrato sul corpo).
Austenite: Soluzione solida interstiziale di carbonio in gamma-Fe (ferro cubico a facce centrate).
Cementite: Un composto stabile (Fe3C) formato dalla combinazione di carbonio e ferro.
Perlite: Miscela meccanica composta da ferrite e cementite (F + Fe3C, contenente 0,8% di carbonio).
Ledeburite: Miscela meccanica composta da cementite e austenite (contenente 4,3% di carbonio).

Il trattamento termico dei metalli è un processo cruciale nella produzione meccanica. A differenza di altri metodi di lavorazione, il trattamento termico non altera la forma o la composizione chimica complessiva del pezzo, ma ne migliora le prestazioni modificandone la microstruttura o la composizione chimica superficiale.
Lo scopo del trattamento termico è quello di migliorare la qualità interna del pezzo, che spesso non è visibile a occhio nudo. Per ottenere le proprietà meccaniche, fisiche e chimiche desiderate di un pezzo metallico, il trattamento termico è spesso necessario in aggiunta alla scelta appropriata dei materiali e dei vari tipi di lavorazione. processi di formatura.
L'acciaio è il materiale più utilizzato nell'industria meccanica e la sua microstruttura può essere controllata attraverso il trattamento termico. Di conseguenza, il trattamento termico dell'acciaio è uno degli aspetti principali del trattamento termico dei metalli.
Oltre all'acciaio, il trattamento termico può essere utilizzato per modificare le proprietà meccaniche, fisiche e chimiche di alluminio, rame, magnesio, titanio e delle loro leghe, consentendo di ottenere diverse proprietà di servizio.